CLDN18.2陽性胃癌に対するゾルベツキシマブ承認

2024年3月26日、CLDN18.2陽性HER2陰性切除不能な進行・再発の胃癌に対して、ゾルベツキシマブ(ビロイ)が承認されました。ゾルベツキシマブは、CLDN18.2を標的とする初めての抗体医薬品です。SPOTLIGHT試験およびGLOW試験の結果に基づき、CLDN18.2陽性患者において有効性が示されています。本稿では、この新規治療薬の特徴と臨床試験結果についてレジメン申請用資料をまとめます。
https://www.astellas.com/jp/news/29026
ゾルベツキシマブの特徴
ゾルベツキシマブは、胃癌の約30%で発現が認められるCLDN18.2を標的とする完全ヒト化モノクローナル抗体です。CLDN18.2は上皮細胞の細胞間接着に関わるタンパク質で、胃粘膜に高発現しています。ゾルベツキシマブは抗体依存性細胞介在細胞傷害活性と抗体依存性細胞媒介細胞傷害活性の2つの機序で腫瘍細胞を攻撃します。
コンパニオン診断薬
コンパニオン診断薬としてベンタナOptiView CLDN18.2が承認されました。これは免疫組織化学染色によりCLDN18.2発現を評価するものです。75%以上の腫瘍細胞で細胞膜に中等度以上の染色がみられた場合にCLDN18.2陽性と判定され、ゾルベツキシマブの適応となります。
ベンタナOptiView CLDN18.2コンパニオン診断薬については、承認取得に合わせて近日中(2024/6頃?)に使用可能になる予定です。
進行胃癌でCLDN18.2の陽性率は40%弱と考えられている。びまん型胃癌で陽性となる割合が若干高いという報告がある。一方でHER2・CPS・MSI・NTRKの陽性などとの相関や交叉性はないとされている。
臨床試験
SPOTLIGHT試験
ゾルベツキシマブ+mFOLFOX6 vs プラセボ+mFOLFOX6
- CLDN18.2陽性率38.2%
- 結果はASCO GI 2023で発表されたのち、Lancetに掲載された。

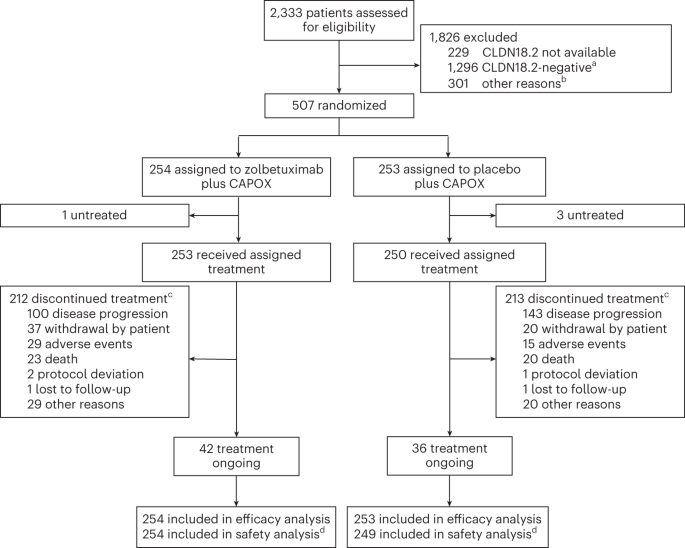
GLOW試験
ゾルベツキシマブ+CAPOX vs プラセボ+CAPOX
- CLDN18.2陽性率38.2%
- 結果はASCO2023で発表されたのち、Nature Medicineに掲載された。
安全性
ゾルベツキシマブ併用群で高頻度に認められた有害事象は好中球減少症、下痢、食欲不振などでしたが、重篤な有害事象の発現率は併用化学療法単独と同程度と報告されています。しかし、実際に治験などで処方経験がある医師の意見を聞くと嘔気症状が強く、しかも従来の制吐剤が効きにくいので対処に難渋したケースが少なくないようです。
まとめ
CLDN18.2陽性HER2陰性進行胃癌に対し、ゾルベツキシマブが新たな治療選択肢となりました。コンパニオン診断薬を用いてCLDN18.2陽性患者を適切に選別することが必要です。ゾルベツキシマブはmFOLFOX6療法やCAPOX療法との併用で良好な有効性と許容可能な安全性が示されており、新たな標準治療の地位を確立すると期待されます。今後、ニボルマブやペムブロリズマブ、トラスツズマブなど既存の治療薬との最適な併用療法の検討が待たれます。
この記事に対するコメント
このページには、まだコメントはありません。
更新日:2024-03-27 閲覧数:1584 views.