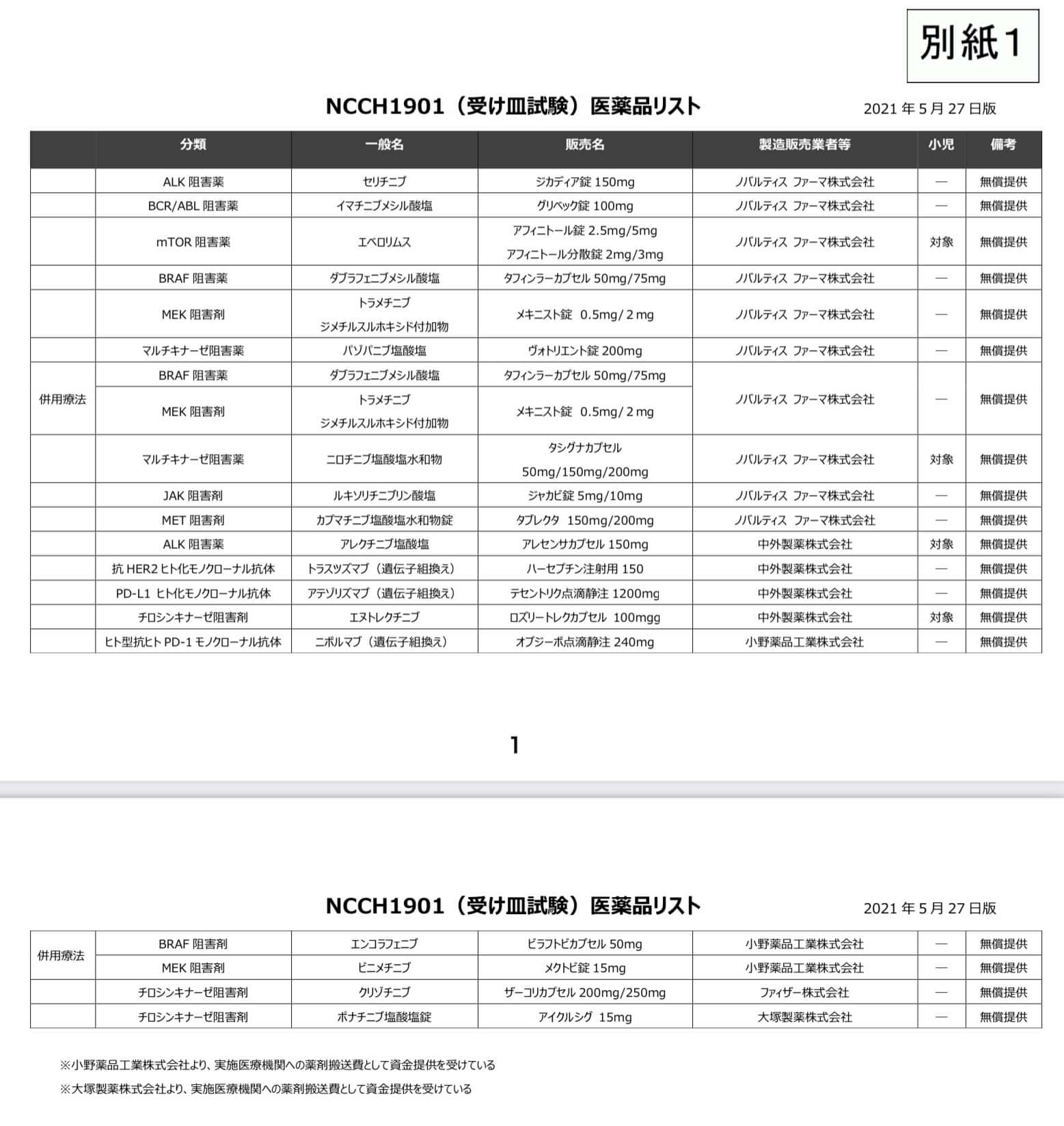
患者申出療養の薬剤無償提供の対象となる薬剤
「遺伝子パネル検査による遺伝子プロファイリングに基づく複数の分子標的治療に関する患者申出療養 (NCCH1901)」、いわゆる「受け皿試験」はいくつかの製薬企業から無償での薬剤提供が行われており、この制度の対象となる薬剤であれば薬剤費の自己負担なく薬剤の投与を受けることができます。研究実施期間は2028年8月31日までの予定です*1。
薬剤費が無償であっても患者申出療養そのものに参加するための費用が数十万円程度必要となり、また薬剤以外の通院治療費・検査費などは保険適用で受けることになります。
なお、1薬剤につきおよそ15症例が集まるごとに有効性評価が行われ、奏効率が十分高い場合は有効中止(企業治験や「医療上の必要性が高い未承認薬・適応外薬検討会議」に回ることになる)となる一方で奏効率が低い薬剤は無効中止となり患者申出療養の対象から外されるようです*2。無効中止の判定のカットオフ値となる奏効率の基準は明記されていないものの、20%程度ではないかと見積もられているようです。
ノバルティス(2019年10月)
2019年10月にまずノバルティスが患者申出療養への薬剤無償提供の契約を締結されました。
2019年10月時点のプレスリリース
https://www.ncc.go.jp/jp/information/pr_release/2019/1002_2/index.html
この時点での対象薬はノバルティスの薬剤で、下記の通り。
- セリチニブ(ALK)
- イマチニブ(KITなど)
- ニロチニブ
- エベロリムス(mTOR系)
- ダブラフェニブ(BRAF)
- トラメチニブ(MEK)
- パゾパニブ(マルチキナーゼ)
- ルキソリチニブ(JAK)
なお、ダブラフェニブ+トラメチニブについては予定症例が集まったため募集が停止しているという情報もあり、患者申出療養を実施しているがんゲノム医療中核拠点病院に確認が必要。
中外製薬(2020年2月)
2020年2月7日に中外製薬も患者申出療養への薬剤提供に関する契約を締結されたことが発表されました。
国立がん研究センターのプレスリリース
https://www.ncc.go.jp/jp/information/pr_release/2020/0207/index.html
中外製薬のプレスリリース
https://www.ncc.go.jp/jp/information/pr_release/2020/0207/202002071500.pdf
- アレクチニブ(ALK)
- トラスツズマブ(HER2)
- アテゾリズマブ(PD-L1)
中外製薬はHER2に関してペルツズマブやT-DM1などの薬剤を有していますが、これらは患者申出療養の提供薬剤には上がっていません。
小野薬品工業
- ニボルマブ(PD-1)
小野薬品工業も抗PD-1抗体ニボルマブの薬剤無償提供を行うことが発表されました。
数はそれほど多くはないものの3社を合わせると比較的多彩な薬剤が取りそろえてられており、いずれかの薬剤が提供対象となっている患者数はそれなりに多くなりある程度のアンメットニーズが満たされつつあるのではないかと思われます。EGFR-TKI、卵巣癌・乳癌以外でのBRCAに対するPARP阻害剤、肺癌以外でのMET阻害剤などに依然として薬剤アクセス性の問題が残る印象です。
2021年1月21日追記
https://www.mhlw.go.jp/content/12401000/000724036.pdf
下記の薬剤も追加になったようです。
- エヌトレクチニブ(中外製薬)
- エンコラフェニブ+ビニメチニブ(小野薬品工業)
- クリゾチニブ(ファイザー)
- ポナチニブ(大塚薬品工業)
利用可能となるのは、エヌトレクチニブ、クリゾチニブ、ポナチニブは2021年3月末頃、エンコラフェニブ+ビニメチニブは2021年4月後半頃と見込まれているようです。
また、小児に対してもエベロリムス、ニロチニブ、アレクチニブ、エヌトレクチニブが対象となったようです。
2021年10月18日追記
https://www.mhlw.go.jp/content/12401000/000844139.pdf
2021年10月18日に第29回患者申出療養評価会議が開催され、従来に募集されていたうちのダブラフェニブ・トラメチニブ併用療法およびニボルマブが予定症例数に達したため募集終了したことが報告されました*3。免疫チェックポイント阻害剤としては他にアテゾリズマブがあります。ノバルティスファーマのMET阻害剤カプマチニブが対象薬剤に加えられています。
医薬品ごとに登録数に一定の上限が設けられており、薬剤により異なるようですが、おおむね医薬品ごとにある程度の探索的な検討が可能になると考えられる 50 例(測定可能病変を有する登録例)を目安としているようです。
2022年3月22日追記
患者申出療養の薬剤にアベマシクリブが追加されることがGemMedにて報じられています。厚労省の2022年3月18日付けの第31回患者申出療養評価会議の議事次第(https://www.mhlw.go.jp/stf/shingi2/0000203222_00017.html)にもアベマシクリブを患者申出療養の医薬品リストに追加する旨が記載されています。

2022年6月25日追記
患者申出療養の薬剤にニラパリブが追加されることがGenMedにて報じられています。初のPARP阻害剤になります。

2022年12月26日追記
患者申出療養に、北海道大学病院のダブラフェニブ・トラメチニブ併用療法のBRAF変異小児固形がんが追加されるとのことです。ただしこれはがんゲノムプロファイリング検査後の受け皿試験(NCCH1901)としてではなく、別個の患者申出療養です。対象は12ヶ月から15歳の小児で、がん遺伝子パネル検査でBRAF V600変異が陽性の固形がんとのこと。関連資料

リキッドバイオプシー(FoundationOne Liquid CDx)における注意点
以下のものは薬事承認の範囲外で、参考データとしてレポートに記載されているに過ぎないものなので、FoundationOne Liquid CDxで検出された下記のものは患者申出療養の対象となりません。(2022年1月現在)
- TMBスコア
- MSI-H判定
- 遺伝子のコピー数変化(amplificationなど)
なお、FoundationOne Liquid CDx(の採血管)の小児に対する禁忌の指定は2023年5月に削除され、小児にも使用可能となった。
この記事に対するコメント
このページには、まだコメントはありません。
*1 https://www.mhlw.go.jp/content/12401000/000844137.pdf
*2 https://www.mhlw.go.jp/content/12401000/000844141.pdf
*3 https://www.mhlw.go.jp/content/12401000/000844138.pdf
更新日:2022-03-22 閲覧数:2337 views.